- HOME>
- お役立ち情報>
- クスリの あ・れ・こ・れ ~東葛病院~>
- No.05:インスリンの後発品はなぜ出ないのか?
クスリの あ・れ・こ・れ ~東葛病院~
No.05:インスリンの後発品はなぜ出ないのか?
薬剤師 青木 千紘
「日常の食生活と生活リズム」
東葛病院は内服薬と外用剤、注射剤、抗がん剤に至るまで後発品(ジェネリック医薬品)を採用し患者さんの医療費負担軽減に努めています。後発品は先発品に劣ることのない品質と有効性が確認された医薬品です。
2011年の国民健康栄養調査で糖尿病の治療を受けている890万人中、インスリンで治療する糖尿病患者は約100万人。インスリンは安くないので後発品を待つ患者さんもいると思います。
現在インスリンを製造販売する会社は、3社のみで似たような作用のインスリンを似たような価格で仲良く扱っています。1923年にインスリンが製剤化し、遺伝子組み換えを施した超速効型インスリンは2001年に販売開始されすでに10年以上経過しています。普通の医薬品が独占販売できる特許期間は10~15年程度であり、インスリンの後発品が出てもおかしくないはずです。
ところが、インスリンはバイオ医薬品なので有効成分の特許が切れても製造工程で多くの特許を持っていて、他社の参入を困難にしています。それでもバイオ医薬品の後発品(バイオシミラー)は厳しい開発要件をクリアして他薬ではすでに市場販売されています。
2013年5月、世界に先駆けて世に出たイーライリリーのインスリン・リスプロ (商品名:ヒューマログ)の特許が米国で切れました。バイオシミラーインスリンをつくる製薬会社が、近いうちに医療業界を大騒ぎさせそうな気がします。
ジェネリック医薬品とバイオシミラーの違い
http://mink.nipponkayaku.co.jp/biosimilar/chigai.html| 名称 | ジェネリック医薬品(後発医薬品) | バイオシミラー |
|---|---|---|
| 定義 | 先発医薬品と有効成分、投与経路、用法・用量、効能・効果が同一の医薬品 | バイオテクノロジー応用医薬品(先行バイオ医薬品)と同等/同質の品質、安全性及び有効性を有する医薬品 |
| 製品特性 | 低分子化合物 | 高分子化合物 |
| 安定 | 安定化に工夫を要する | |
| 同一性を示すことが容易 | 分子構造が複雑であり、同一性を示すことが困難なため、同等性/ 同質性を示すことが必要 | |
| 製造 | 化学合成により製造 | 細胞培養技術を用いた製法 |
| 開発要件 | 生物学的同等性試験(静注は免除) | 独自のセルライン・セルバンクを研究開発 品質特性(有効成分・不純物等)の同等性/同質性の比較 非臨床試験で比較及び安全性の確認 臨床試験で同等性/ 同質性の比較(薬物動態(PK)試験、薬力学(PD)及びPK/PD 試験を含む)及び安全性の確認 製造販売後調査(免疫原性の問題等に留意する) |
| 薬価 | 先発品の70% | 先行バイオ医薬品の70% |
| 薬価収載企業が10社を超える場合は60%となる | 臨床試験が必要なことから10%を上限とした上乗せが相談事項として認められている |
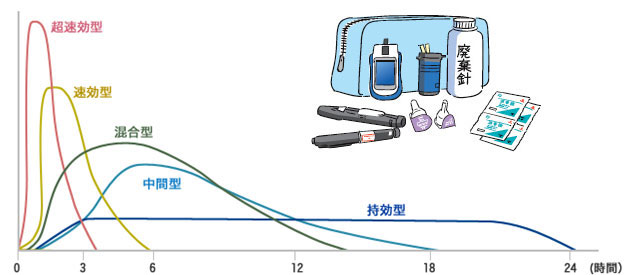
■インスリン製剤の種類と作用時間(作用イメージ)