イレッサの多くの「なぜ?」に、答えていきます。
最高裁判所前で、2012年8月から毎月配布しているチラシに連載中。
◆ 《薬害イレッサQ&A》 印刷用pdf
さらに詳しく知りたい方は「参考資料」をご覧ください。
Q:イレッサの被害は防止できたのですか。
| 年 | 年間死亡者数(人) | 累計(人) |
|---|---|---|
| 2002 | 180 | 180 |
| 2003 | 202 | 382 |
| 2004 | 175 | 557 |
| 2005 | 80 | 637 |
| 2006 | 52 | 689 |
| 2007 | 38 | 727 |
| 2008 | 44 | 771 |
| 2009 | 34 | 805 |
| 2010 | 16 | 821 |
| 2011 | 23 | 844 |
| 2012 | 3 | 847 |
A:注意喚起によって防止できました。それは被害者が減少したことから明らかです。
イレッサは、「副作用の少ない画期的な新薬」として期待されていましたが、承認直後から副作用である間質性肺炎による死亡報告が相次ぎ、承認から3か月後の同年10月、緊急安全性情報が発出されました。
イレッサの副作用死亡者は、承認から半年後の2002年12月末までで180人、2004年12月末までに557人に達しており、承認直後の2年半に集中しているのが特徴です。
しかし、これらの被害者も充分な注意喚起があれば、防ぐことができたのです。
すなわち、2002年10月15日の緊急安全性情報の発出前の4週間で161件(うち死亡例74件)だった副作用の報告件数は、添付文書による警告が出された直後の4週間では62件(うち死亡例22件)と激減したのです。
さらに、2002年12月末に安全性検討委員会に基づく通知が発出される直前4週間の副作用報告数は、平均23件(うち死亡症例8件)でしたが、通知が発出された直後の4週間では15件(うち死亡症例6件)と減少しました。
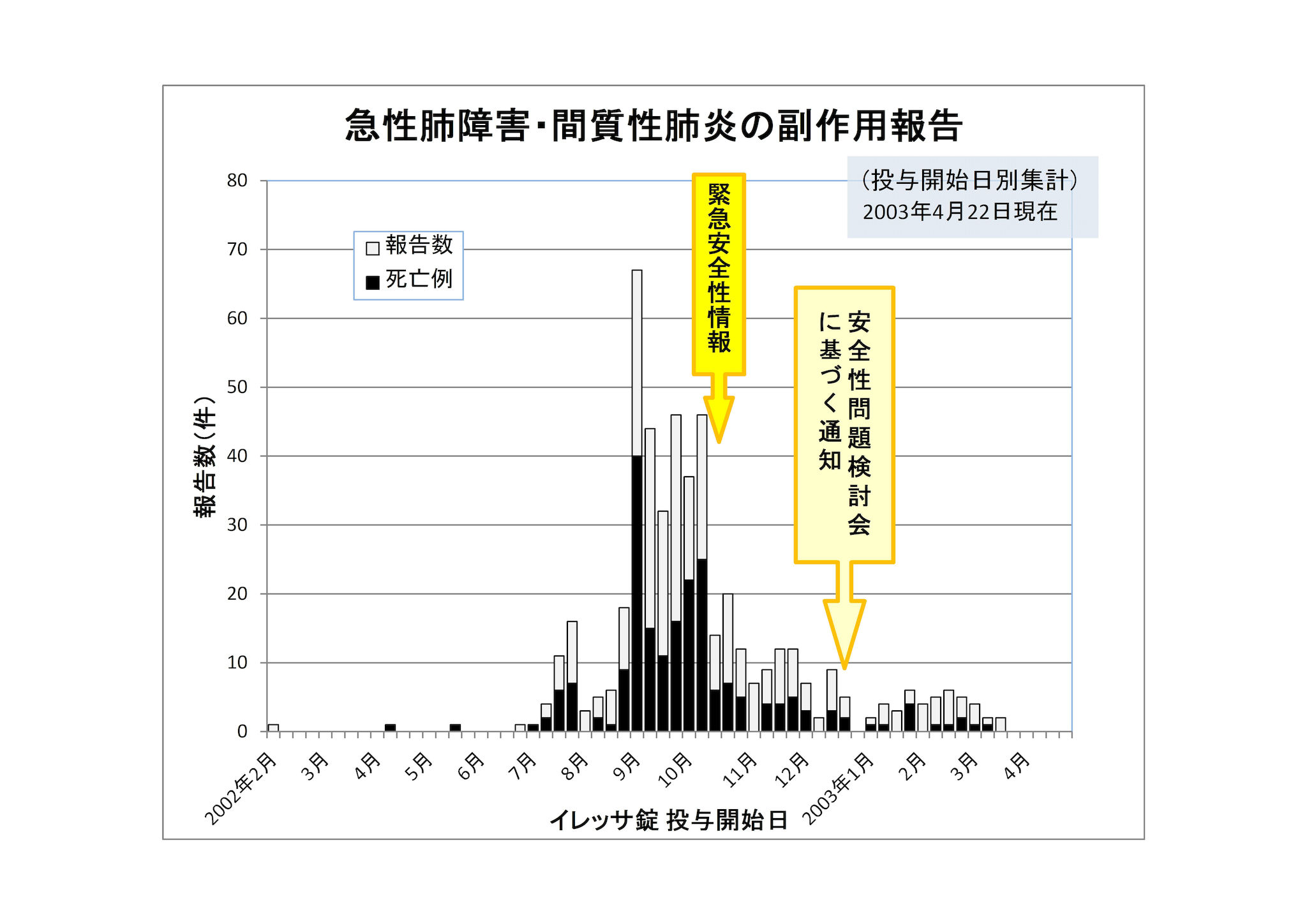
その上、イレッサの副作用被害が社会問題化し、イレッサの副作用の危険性が広く浸透して医師も慎重に投与するようになってからはさらに被害は減少し、2011年には副作用死亡者は年間23人、2012年は3月まででわずかに3人となっているのです。
このように、イレッサの承認当初から注意喚起が充分にされていれば、これまでの薬害でも例を見ない甚大な副作用死亡被害は、防ぐことが可能だったのです。
Q:薬害イレッサ訴訟が抗がん剤副作用被害救済制度の創設を求めるのはなぜ?
A: 薬害スモンの闘いを通じて医薬品の副作用については、薬害を含め幅広くこれを救済する制度が1980年に作られました。しかし、この制度の救済対象外とされたのが、後に薬害エイズ、薬害ヤコブで問題となる生物由来製品の感染被害(2002年に救済制度がスタート)と抗がん剤の副作用でした。
薬害イレッサ訴訟は既に起きた副作用被害について、企業と国の責任を追及する薬害訴訟ですが、同時にこれから生じる抗がん剤による死亡や重篤な副作用被害については広く救済できる制度を作ることで、安心安全な抗がん剤治療を進めることに役立てればと、この制度作りを全面解決要求の大きな柱としています。
昨年厚生労働省に設置された抗がん剤等による健康被害の救済に関する検討会審議会(森嶌昭夫座長)では、北欧、フランス、ニュージーランドで抗がん剤の副作用を救済対象としていることが確認されました。日本でもがんに用いられるホルモン製剤は対象とされており、対象外とされる他の抗がん剤との間に明確な線引きの基準がないことも分かりました。抗がん剤だからと除外するのは合理的ではありません。その気になれば作れます。
薬害イレッサ原告団・弁護団・支援連は、死亡や重篤な副作用を救済対象とする試案を作成し厚生労働省に提出しています。給付金は、既存の救済制度と同様に製薬企業の拠出金により運営されるものとしています。特に多くの副作用被害を出した企業には特別拠出金が付加される仕組みとなっています。これにより、企業は副作用被害を出さないためにより一層副作用情報の収集と提供につとめることが期待されます。イレッサという錠剤の成分は何一つ変わらないのに、その被害発生を大きく低下させたのは、警告等の情報提供でした。
救済制度の創設は、情報提供にも大きな意味を持ちます。検討会はこの8月にとりまとめをし、引き続き政府に対し制度創設の検討の継続を強く求めています。薬害イレッサ問題を解決するには、この制度創設が何より求められています。
Q:イレッサは、世界で広く使われているのですか?
A:広く使われているわけではありません。
世界的に医薬品規制をリードしているのは、米国・EU・日本の3極の規制当局と製薬産業界の代表で構成されるICH(日米EU医薬品規制調和国際会議)とされています。
そのうち、アメリカでは、日本人のような副作用が認められないこともあって、いったん承認がなされましたが、臨床試験(第3相)の失敗を受けて2005(平成17)年6月から新規患者への投与が禁止され、2011年(平成23年)9月、アストラゼネカはアメリカでの承認を撤回しました。
また、EUでは、2005年1月にイレッサの承認申請が取り下げられました。その後、再承認申請を受けて、2009(平成21)年7月にイレッサが承認されましたが、対象者を遺伝子変異のある患者に限定した上での承認です。
なお、遺伝子変異のある患者の割合は、東洋人で3割程度、非東洋人で1割程度と言われています。
我が国は、2002(平成14)年7月5日、世界に先駆け、医薬品として国の承認を受けていますが、臨床試験で失敗しているにもかかわらず、広い適応での販売が継続され、遺伝子変異患者に限定されたのは2011年(平成23年)11月に至ってでした。
現在、日・米・EU以外の国で承認されているのは、オーストラリア、アルゼンチン、メキシコ、シンガポール、韓国等のアジア諸国くらいですので、決して世界で広く使われているわけではありません。
Q:イレッサは抗がん剤なので、原告被害者も危険を承知で飲んだのではないですか?
A: 危険性は、現場の医師には十分に伝わっていませんでした。
イレッサについては、製造・販売元であるアストラゼネカ社が、承認される前から広告・宣伝を繰り返し行っていました。イレッサは、これまでの抗がん剤とは異なり、がん細胞だけを狙い撃ちする分子標的薬だから、副作用の少ない安全な薬だと大々的に宣伝していたのです。そのため、医療現場においてイレッサが副作用の少ない安全な薬だという認識が広まっていましたし、肺がん患者も“夢の新薬”が承認されるのを心待ちにしていました。
イレッサを服用することを選択した原告たちの当時の心境は、次のようなものでした。
東日本訴訟原告 近澤さん
「イレッサに関する記事はどれもイレッサを推奨するものばかりで、不安を感じる情報はどこを探しても見当たりませんでした。主治医に尋ねると、『副作用がほとんどない。手軽に服用できて、効果もすばらしい。』などと言いました。こんなに素晴らしい抗がん剤ならば、娘に何としても早く飲ませてあげたいと願いました。」
西日本訴訟原告 清水さん
「医師から、『承認されたばかりの新薬でイレッサという薬があります。この薬は分子標的治療薬といってガン細胞だけをやっつけてくれる薬で,副作用は,下痢,発疹とごくまれに肺炎があるだけです。家で1日1錠飲むだけですよ。』と説明がありました。イレッサの話を聞いて希望が湧いてきました。放射線治療で叩いて、イレッサでとどめを刺すという気持ちでした。」
このように、原告たちは、わらをもすがる気持ちで危険な薬に手を出したわけではありません。副作用の少ない安全な薬を飲んで、もっと元気になって長生きしたいという希望に胸をふくらませていたのです。ところが、イレッサは、そのような原告たちの希望を無残にも打ち砕いたのです。
Q:2002年7月のイレッサが承認された時点では、致死的な間質性肺炎の危険性はわからなかったのでしょうか?
A:そのようなことはありません。
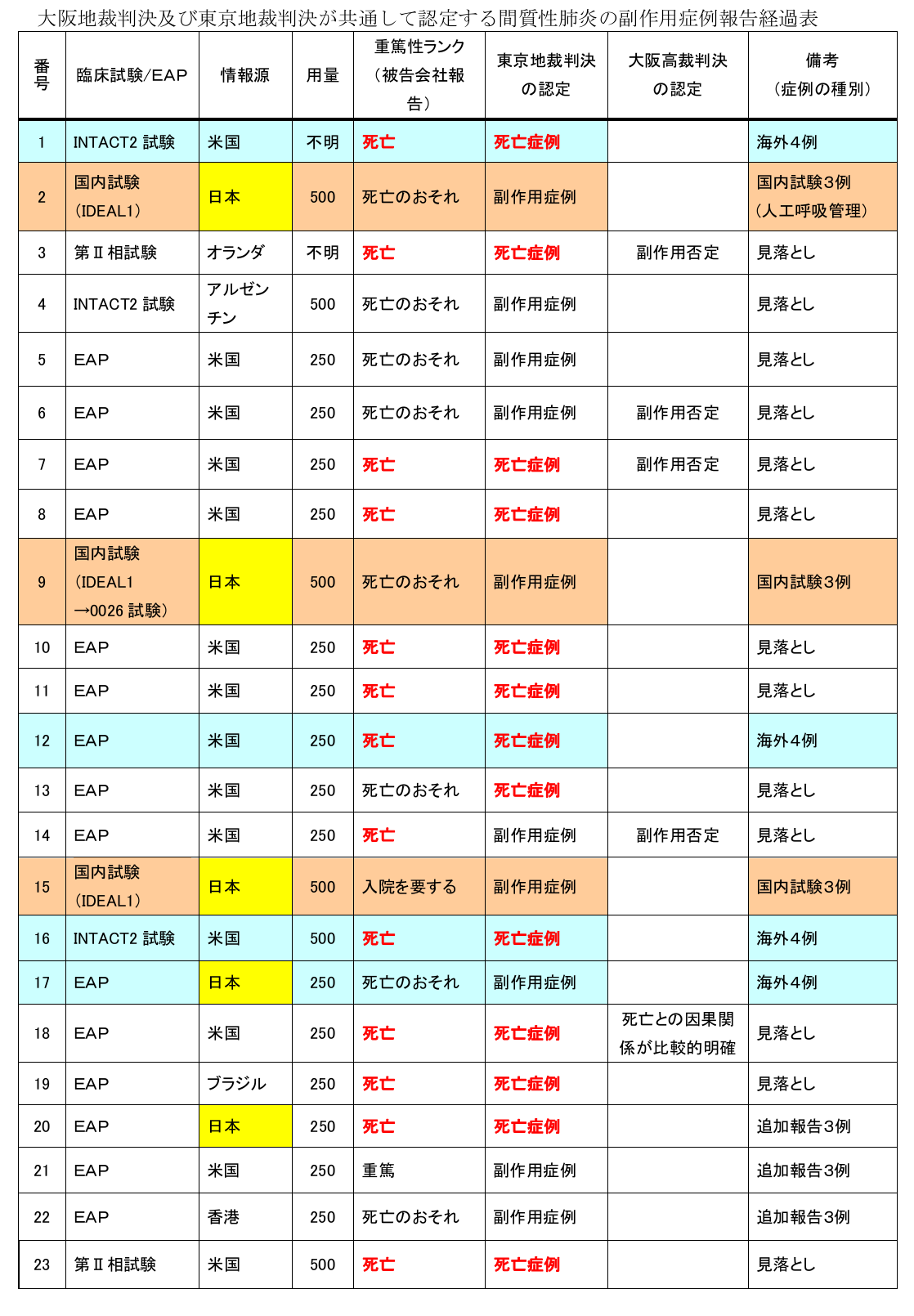
承認前に、既にイレッサによる致死的な間質性肺炎の副作用症例が多数ありました。
それにもかかわらず、この危険性が添付文書に充分に記載されず医療現場に伝わらなかったのです。
<23例の副作用症例、うち13例は死亡例>
右の表は、イレッサ承認時点で認められた副作用症例を、大阪地裁判決及び東京地裁判決が共通して認定したものです。
23例の副作用症例がアストラゼネカ社と国に届き、うち13例は死亡例という極めて致死的な副作用が認められていたのです。
<表の備考欄にある「見落とし」とはなんでしょう>
国は企業、医療機関を経由して入ってきた副作用症例報告を副作用症例票の「副作用名」欄だけでスクリーニングしていたのです。(これは国の申請証人となった平山佳伸現審議官、イレッサ承認時の審査センター担当が認めたことです)。
内容まで見れば間質性肺炎であることがわかる症例も、副作用名欄の記載によって内容も見ずに切り捨ててしまったのです。その結果、大量の「見落とし」が発生しました。
未知の副作用ではありません。わかっていた危険性を添付文書で「警告」しなかったことが問題なのです。
Q:薬害イレッサは裁判所が和解勧告を出したと聞きましたが、どうして和解が成立しなかったのですか?
A:厚労省による「やらせ」という「和解つぶし工作」があったからです。
厚労省元審議官も和解を提言していたのに・・・。
2011年1月7日、東京地裁と大阪地裁は、6年以上の審理の末、和解による解決を勧告しました。原告は、早々に和解協議の席に着くと回答をしました。また1月19日には、厚労省の元審議官・土井脩氏が「被害は防げたはずで、国と企業は和解協議に応じるべきだ」とする見解を新聞紙上で明らかにしました。
しかし、1月24日から翌日にかけて、国立がんセンターの他、日本臨床腫瘍学会他の関係医学会が和解協議に応じるべきではないとする見解を公表しました。同じ日にアストラゼネカ社が和解協議を拒否、回答期限の1月28日には国も拒否を表明しました。
和解つぶしのためなら「何でもやる」ことを決定
後に、この一連の医学会等の見解は、厚労省が依頼したものであり、中には厚労省が声明の下書きまで提供していたものがあることが分かりました。この下書き提供問題は、国会質問でも取り上げられ調査チームが発足しました。
調査の結果、厚生労働省は関係者に働きかけ和解勧告に対する否定的見解を集めるために「何でもする」ことを決めたうえで「アタックリスト」なるものを作っていたことが明らかになりました。また「裁判所の所見に従うならば、あらゆる未知の危険まで明らかにならないと抗がん剤のような新薬の承認ができなくなることを意味しています。」「今後リスクのある医薬品の承認はますます困難になります。」などというメールを発信していたことも明らかになりました。
やらせによる和解つぶしの全容解明を
下書き提供問題に関して、厚生労働省は、局長以下関係者4名を処分しましたが、全容は未だ解明されていません。厚労省が、自らの有利になるよう政府の意思決定を歪めるべく関係諸団体に働きかけた“やらせ”を演じたことは許されないことではないでしょうか。
Q:イレッサの被害を防ぐことはできなかったのですか?
A:安全対策により被害は急減! 防ぐことはできたはず
イレッサの服用により、僅か3ヶ月で162名、半年で200名の方が亡くなりましたが、10月15日の緊急安全性情報や添付文書改訂、12月の添付文書再改訂などの安全対策で被害は急減しています(投与開始日基準)。
| 承認~10月15日 | 162名 |
| ~12月26日 | 38名 |
| ~翌年4月22日 | 14名 |
これは、安全対策をきちんとすることで、被害を防げたことを如実に示しています。
イレッサの被害発生の要因
イレッサ承認まで、大阪高裁の認定によっても、少なくとも11例の死亡例を含む19例の副作用報告がありました。10月15日の緊急安全性情報を出す根拠となった副作用報告は11例の死亡を含む22例の症例(162例の死亡というのは後に判明したことです。)だったことと比較しても、イレッサの危険性を示す十分な数字です。
他方、薬剤による間質性肺炎は、薬剤ごとに危険性が異なり、従来の抗がん剤は予後不良となることがあるが、全体としては予後は悪くないとされていました。イレッサは、従来の抗がん剤とは異なる分子標的薬だとされており、しかも、「副作用が少なく軽い」という情報が広く行き渡っていました。
そこで、現場の医師等に対して、イレッサの危険性を十分伝える必要がありましたが、イレッサの添付文書では、単に「間質性肺炎があらわれることがある。」と記載されていただけでしたので、医師等に危険性が伝わらなかったのです。そのため、副作用に無防備、無警戒となって、被害が発生、拡大したのです。
承認当初に安全対策できなかったのか
上記の被害発生の要因は、全て、アストラゼネカも国も十分に把握できるものでした。したがって、安全対策を講ずることは十分に可能でしたし、講じなければなりませんでした。
しかし、アストラゼネカも国も、11例の死亡を含む19例もの副作用報告を十分に検討しませんでした。国が審査に反映したのは、19例中、僅か7例にすぎず、12例を見落とし、または軽視したのです。国は、副作用報告名が「間質性肺炎」でなく「呼吸困難」等だったと言い訳していますが、報告の症例経過には明確に「間質性肺炎により死亡」と記載されているなど、報告内容を見れば、イレッサの副作用であることを簡単に把握できるものだったのです。こうした見落としのために、適切な安全対策が取られず、多くの被害が発生したのです。
Q:イレッサの添付文書では,多くの方が亡くなった原因である間質性肺炎を,どのように扱っていたのですか?
A:イレッサの添付文書は、発売から現在まで次のように改訂が繰り返されています。間質性肺炎に関する記載内容は最初のころはごく小さなものに過ぎませんでした。現在(第22版)のものと比較すると注意喚起はあまりにも不十分なものでした。
イレッサが発売された2002年7月作成(第1版)の添付文書では,間質性肺炎のことは最初に目にする1ページには何も記載されていません。2ページの「重大な副作用」欄に4つの副作用例が記載され,その4番目に「間質性肺炎(頻度不明):間質性肺炎があらわれることがあるので、観察を十分に行い、異常が認められた場合には、投与を中止し、適切な処置を行うこと」との記載があるだけでした。

発売からわずか3か月の間に11名もの死亡が相次ぎ,2002年10月15日アストラゼネカ社は緊急安全性情報を出しました。これと共に添付文書が改訂(第3版)され,1ページ目に初めて警告欄が設けられました。そこで「本剤の投与により急性肺障害,間質性肺炎があらわれることがある」と記載され,重要な基本的注意に「急性肺障害,間質性肺炎等の重篤な副作用が起こることがあり,致命的な経過をたどることがある」との記載が加わりました。

緊急安全性情報が出された後も死亡報告が相次ぎ,わずか2ヶ月後の2002年12月には再び添付文書が改訂(第4版)され,警告欄に「急性肺障害や間質性肺炎が本剤の投与初期に発生し,致死的な転帰をたどる例が多いため,少なくとも投与開始後4週間は入院またはそれに準ずる管理の下で,間質性肺炎等の重篤な副作用発現に関する観察を十分に行うこと。」「本剤は,肺癌化学療法に十分な経験をもつ医師が使用するとともに,投与に際しては緊急時に十分に措置できる医療機関で行うこと。」との記載が加わり,専門医により十分な医療体制の下で服用後の経過観察を行うことが求められるようになりました。
さらに慎重投与(次の患者には慎重に投与すること)を要する患者として「急性肺障害,間質性肺炎,肺線維症またはこれらの疾患の既往歴のある患者〔間質性肺炎が増悪し,致死的となる症例報告されている〕」との記載が第4版で初めてなされました。

発売から9年が経過した第22版では,1ページ目の約4分の1が警告欄に充てられ,5項目の警告が記載されています。効能・効果欄には「EGFR遺伝子変異陽性の手術不能又は再発非小細胞肺癌」に適用すべきであることも記載されました。2011年の死亡例報告数は年間で23名でした。
このように,発売からわずか半年(2002年7月から12月まで)の間に180名もの方がイレッサにより亡くなったことで,間質性肺炎に関する注意喚起が段階的に進められました。現在もイレッサによる間質性肺炎で年間10~20名の副作用死亡が報告されていますが,当初のようにひと月で数十名もの方が亡くなることはありません。発売当初から適切な注意喚起がなされていれば,未曾有の副作死亡被害は防げたのです。
Q:イレッサの日本人に対する有効性は明らかなのでしょうか?また、イレッサが全く効かない多くの患者に使われてきたというのは本当でしょうか?
A:イレッサが生存期間を長くする効果は、いまだ確認されていません。
他の医薬品と同様、抗がん剤も、有効性があるというためには大規模な比較臨床試験(第Ⅲ相臨床試験)による確認が必須です。通常の医薬品は承認前に有効性を確認しますが、抗がん剤の場合、患者のために早期に市販を認めるということから、ガイドラインによって、市販後に第Ⅲ相臨床試験を行って有効性(延命効果)を確認することも認められていました。
しかし、イレッサは、その承認にあたって承認条件とされた日本国内の第Ⅲ相臨床試験(V1532試験)で延命効果の証明に失敗しました。海外で見ても、INTACT1・2試験、ISEL試験、SWOG0023試験と失敗を繰り返しました。
なお、最近、海外のINTEREST試験、アジアでのIPASS試験、日本でのNEJ002試験結果などによりイレッサの有効性が論じられています。しかし、INTEREST試験はV1532試験と同様のデザインであり、上述のとおり日本ではこのデザインの試験で延命効果は認められなかったのです。
また、IPASS試験は肺がんの種類(腺がん)や非喫煙者など、イレッサの効果が期待できると想定されていた因子で対象者を絞り込んだ試験であり、これは、EGFR遺伝子変異が陽性の患者に絞ったNEJ002試験も同じです。
そして、日本でのNEJ002試験などは、腫瘍縮小の期間を第1の評価指標として行われた試験であり、患者の全生存期間を第1の評価指標として延命効果が確認された試験結果は未だ出ていません。
他方、遺伝子変異のない患者には、腫瘍の縮小すらほとんど見られないことは明らかとなっています。
つまりイレッサは、有効性の確認もないまま「見切り発車」で販売開始され、その後まるで「人体実験」のように、どのような患者に効くのかを様々な試験を通じて探り続けてきたため、全く効かない多くの肺がん患者に処方され、多くの副作用被害を生み出してきたのです。
Q:薬害イレッサ訴訟の原告側の主張を認めると、がん医療の後退につながるとか、新薬の承認ができなくなると聞きましたが、本当ですか?
A:薬害イレッサ訴訟のたたかいは、がん患者の権利の確立とがん医療の進歩に貢献してきました。
(1)私たちが訴訟でたたかうなかで、がん患者の権利とがん医療の進歩にとって、いくつかの成果がありました。例えば、
①延命効果を確認してから
抗がん剤は市販後に第Ⅲ相臨床試験を行って有効性(延命効果)を確認することも認められていました。しかし、イレッサでは様々な大規模臨床試験を行ったにもかかわらず日本人への延命効果が認められませんでした。現在では、抗がん剤は市販前に延命効果の確認を行うことになっています。
②使った患者の追跡を
イレッサには、服用した患者がその後どうなったかを追跡調査することは義務付けられていませんでした。しかしイレッサ薬害をうけて、後発薬のタルセバでは使用患者への全例調査が義務付けられました。
③適応範囲の限定を
また、イレッサの適応患者を、少なくともEGFR遺伝子変異のある方に限定することを主張してきましたが、これはア社によるイレッサの再申請が承認された2011年10月に実現しました。
④副作用救済制度の検討会が設置された
被害の実相を広げることで、抗がん剤であっても他の医薬品と同様に、副作用被害を受けた場合の救済措置を設けるべきだという認識が広まり、厚労省にも検討会が設置されました。
(2)新薬の開発や承認迅速化は、薬害イレッサの教訓をくみ取ってこそ促進されます。
イレッサは、日本が世界に先駆けて新薬の承認を行ったのであり、いわゆるドラッグ・ラグ(外国で承認され有用と評価されている新薬があっても、日本になかなか入ってこない)の問題ではありません。むしろ、国と製薬企業が安全性にかかわる情報を無視又は軽視したせいで起こるべくして起こった事件なのです。多くの方々が短期間に集中して亡くなった薬害イレッサがなぜ起きたのか教訓をくみ取り、再発防止をはかることが、今後の新薬開発や迅速承認にも役立ちます。
また、がん基本法にがん患者の権利を明記させることで、例えば、危険情報はより素早く正確に医療従事者や患者に届くようにするなど、患者の自己決定権をより重視するシステムにしていくこともできるでしょう。
私たちは、より良いがん医療を求め、「がん患者の命の重さを問う」たたかいを進めていきます。
・ パンフレット「薬害イレッサ訴訟 最高裁での早期全面解決を」薬害イレッサ訴訟統一原告団・弁護団発行
A4版12ページ (2013/1) 頒価200円で普及を進めています。
薬害イレッサ訴訟パンフレット2013.pdf
・ 最高裁宣伝チラシ (2012/11/28)
・ 最高裁宣伝チラシ (2012/8/24)
・ リーフレット「最高裁での勝利をめざして」 (2012/4/16)
・ 薬害イレッサの責任を明らかにし、早期解決を望みます
― 最高裁判所への上申書 ― 藤竿伊知郎(2012/4/19)
・ イレッサ販売金額の推移
販売額から投与患者数の推定、諸外国と販売量の差を示す。 (2013/02/12)
・ イレッサの副作用被害者数
副作用死の減少に、安全対策が十分でなかったことを示す。 (2012/11/20)
2012年9月末までに厚生労働省へ報告された副作用症例数は2328、そのうち死亡患者は857人。
・ 薬害イレッサ 用語集 第3版 (2009/06/10)
このページ トップへ↑